缓冲区的解决方案
如何制作缓冲解决方案的定义、解释和示例。
一个缓冲溶液是一个解抵抗pH值的变化当少量的H+离子(酸)或OH-离子(碱)被加入。通过选择正确的组分,溶液可以缓冲到几乎任何pH值。
缓冲溶液可能含有弱酸及其盐(HA + MA,其中M为盐阳离子)或弱碱及其盐(B + BHN),其中N为盐阴离子)
缓冲溶液之所以能够抵抗pH值的变化,是因为酸HA和它的共轭碱A之间存在平衡−.
- Ha⇌h++一个−(我)情商。
- 当H+被添加到缓冲溶液中时,它基本上与存在的弱碱发生反应:
H++一个-→HA或H++ b→bh+
- 当OH-被添加到缓冲溶液中时,它基本上与弱酸发生完全反应:
哦-+ ha→a-+ H2O或OH-+黑洞+→b + h2O
- 缓冲溶液的pH值由弱碱和弱酸浓度之比决定。只要这个比例保持不变,pH值就会保持不变。只要缓冲材料的浓度(HA和A-)或(B和BH+)的含量比H的含量大+或哦-补充道。
对于一个酸性溶液(不含盐)我们有一个平衡常数K一个:
K一个= [H+] [-] /[哈哈]
我们可以假设浓度[H+]和[A]-]是相同的,如果酸是弱的,比[HA]要小得多。我们可以假设,只有很少的酸被电离,以至于平衡状态下酸[HA]的浓度与我们使用的酸的浓度相同。
当我们加入相应的含有A的盐(MA)时,情况就不一样了-和M+离子。那么Eq. I将被进一步推到左边,根据平衡解的勒夏特列原理。那么我们可以假设[A-]与盐MA的含量相同。酸的浓度[HA],仍然可以假设与我们使用的酸的浓度相同,现在平衡已经进一步向左移动。(由于缺乏H+它不会比初始离子高)
缓冲容量缓冲溶液的容量是根据它在ph值没有显著变化的情况下可以吸附的质子或氢氧根离子的数量来定义的。因此,具有高浓度缓冲化合物的溶液将具有高缓冲容量。
- 的pH值缓冲溶液的大小是由(-) / (HA)的比例
- 的缓冲capasity依赖于[A-]和[HA]的大小.
对于已知酸和共轭碱浓度的溶液,可以使用Henderson-Hasselbalch方程,在日志表格上:
pH = pK一个+ log, n .日志-]/[HA]) = pK一个+ log([碱]/[酸])
- 最好的缓冲效果是当[A-]/[HA] = 1。然后酸进行pK一个等于ph。这意味着我们应该瞄准具有pK的缓冲酸或碱一个与所需pH值最接近的值。
为了更好地理解和帮助计算,给出了以下例子:
另请参阅苯酚、醇和羧酸的pKa,胺、二胺和环有机氮化合物的pKa而且无机酸碱的pKa还有强酸弱碱.
例1:计算给定缓冲溶液的pH值
缓冲溶液由等量的0.40 M CH制成3.COOH(乙醇)和0.25 M NaCH3.COO(乙醇酸钠)。溶液的pH值是多少?
(M = mol/ l溶液)
pKa代表乙醇是4.76,所以是K一个= 10(-4.76)= 1.74 * 105
K一个= [H+] [CH3.首席运营官-] / [CH3.COOH]和[H+= k一个(CH3.羧基]/ [CH3.首席运营官-]
[H+] = 1.74*105*0.40/0.25 = 2.78*105
pH值=-log[H+] = -log (2.78*105) = 4.56 =4.6(由于输入值中有多个有效数字,所以只有两个有效数字)
或通过使用Henderson-Hasselbalch方程:pH值= 4.76 + log(0.25/0.40) = 4.76 -0.20 = 4.56 =4.6
回到顶部
例2:制作具有所需pH值的缓冲溶液
多少CH3.COOH(乙醇)和NaCH3.COO (sodium ethanol ate)我们是否需要制作pH值为3.95的缓冲溶液?
酸平衡方程:
CH3.羧基(aq)↔h+(aq)+ CH3.首席运营官-(aq)
K一个= [H+] [CH3.首席运营官-] / [CH3.COOH]和[CH3.首席运营官-] / [CH3.Cooh] = k一个/ (H+]
pH = 3.95对应的浓度[H+] = 10(-3.95)= 1.12 * 104
pKa代表乙醇是4.76,所以是K一个= 10(-4.76)= 1.74 * 105
然后,(CH3.首席运营官-] / [CH3.Cooh] = 1.74*105/ 1.12 * 104= 0.16
这意味着钠盐的浓度应该是乙醇浓度的0.16倍。
如果你从1.0升的1m乙醇开始,你可以加入1升的0.16 M乙醇钠。(M = mol/ l溶液)
图中为加入HCl后缓冲溶液pH的变化:
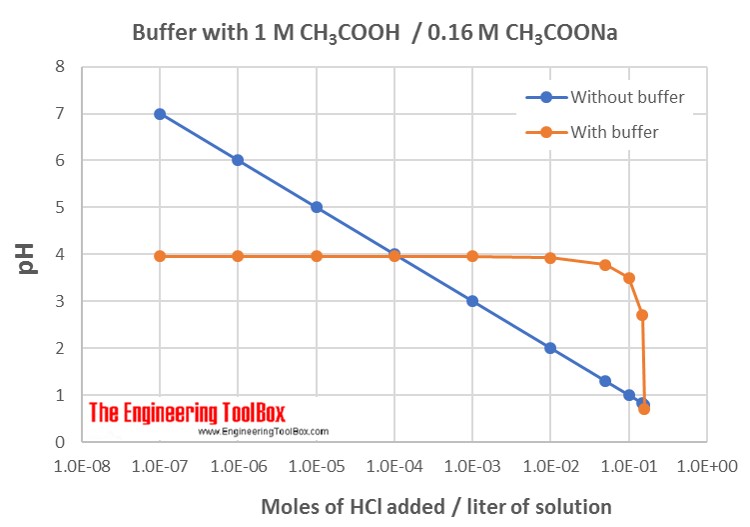
注1:这可以用不同浓度的两种溶液来解决。然而,必须调整数量,使添加CH之间的比例3.首席运营官-和CH3.COOH在混合物中保持0.16。
注2:当CH3COO的用量-相对于CH3COOH的量较小,在这种情况下,缓冲效果会比两者的量更相等时小。为了弥补这一点,你可以增加两者的浓度(它们之间的比例仍然相同),或者通过pK找到另一对酸和盐一个更接近你想要的pH值。(例如pKa = 3.74的甲酸(HCOOH)和盐甲酸钠(HCOONa))
例3:制作pH大于7的缓冲溶液
如何制作碱性缓冲溶液,例如pH = 9.1?
当pH值为9.1时,我们将处于碱性的一边,OH-离子比H+离子占优势。然后,你应该找到一个碱和它的盐来生产缓冲液,例如碱氨(NH3)和它的盐氯化铵(NH4Cl)。
平衡方程为:
NH3.(aq) + h2O (l)↔nh4+(aq) + oh-(aq)
Kb=[哦-] [NH4+] / [NH3.[NH .4+] / [NH3.= kb/(哦-]
对于氨,pK一个= 9.24。然后,pKb= 14 - pK一个= 14 -9.24 = 4.76和Kb= 10(-4.76)= 1.74 * 105
我们还有:pH +pOH = 14和pOH = 14 - pH = 14 - 9.1 = 4.9 [OH-] = 10(-4.9)= 1.26* 105
我们把K代入方程b和[哦-]:(NH4+] / [NH3.]= Kb/(哦-] = 1.74*105/ 1.26 * 105=1.38
要制作pH = 9.1的缓冲液,可以从1.4升1m氯化铵水溶液开始,然后加入1.0升1m氨水溶液。(M = mol/ l溶液)
注意:这可以用不同浓度的两种溶液来解决。然而,必须调整数量,以使[NH4+] / [NH3.]比例仍然是1.38。
例4:如何制作1.4升1m (mol/l溶液)氯化铵水溶液?
氯化铵的摩尔重量,NH4肤色线:
1 mol N: 14.01 g/mol, 1 mol H: 1.01 g/mol, 1 mol Cl: 35.45 g/mol
1mol NH4Cl:(14.01 + 4*1.01 + 35.45) g/mol = 53.50 g NH4Cl /摩尔
对于1.4升,我们需要:1mol /l *53.5 g nhh4Cl/mol * 1.4 l =74.9 g NH4Cl
加入74,9 g nhh4将Cl倒入瓶中,加入大约1升水。搅拌直到盐全部溶解。向1.4升溶液中加入更多的水。
例5:如何制作1.0升1m氨水溶液?
氨在室温下是一种气体,但它也可以作为溶解在水中的液体,通常是按重量计30%的氨在水中。
对于1.0升1m的溶液,我们需要1mol NH3.1mol NH3.:(14.01 + 3*1.01) g/mol = 17.04 g NH3./摩尔
100克30重量%的氨溶液含有30克氨。我们需要:(100g溶液/30g氨)* 17.04 g氨= 56.80 g 30重量%溶液。
所以:添加56.8克30重量% NH3.将溶液倒入瓶中,加水至1升。
回到顶部
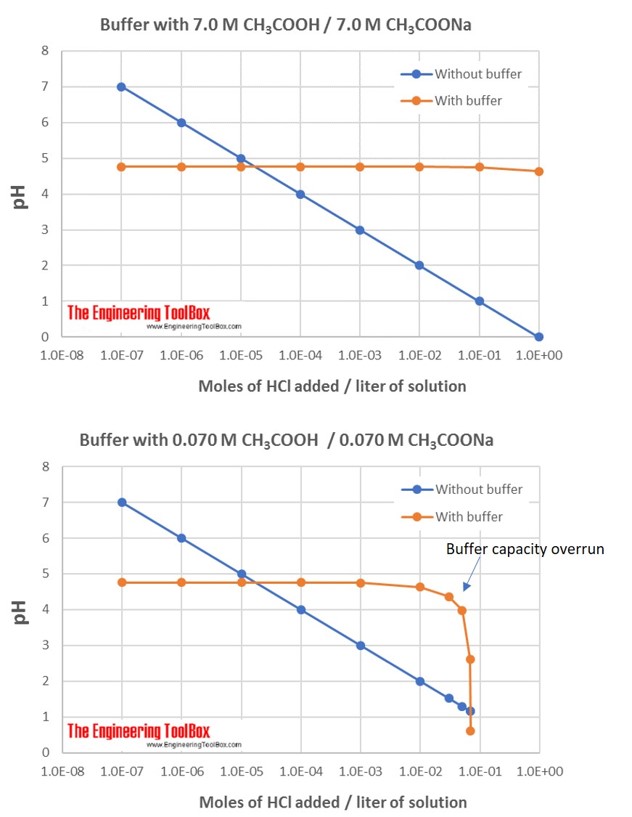
例6:缓冲区容量的差异
将0.20 mol气态HCl加入到0.5升的以下两种溶液中,pH值会发生什么变化?
1.7.00 m ch3.COOH和7.00 M CH3.COONa
2.0.070 m ch3.COOH和0.070 M CH3.COONa
(M = mol/l溶液)
pK一个对于乙醇,(CH3.羧基)= 4.76,得到K一个= 10(-4.76)= 1.74 * 105
根据Henderson-Hasselbalch方程:pH = pK一个+ log, n .日志-] /[哈哈])
解决方案1:pH = 4.76 + log ([7.00]/[7.00]) = 4.76 + log (1) = 4.76 + 0 = 4.76
解决方案二:pH = 4.76 + log ([0.070]/[0.070]) = 4.76 + log (1) = 4.76 + 0 = 4.76
加入HCl气体后溶液中存在的物种:
H2o ch3cooh ch3coo-Na+H+Cl-
Na+和Cl-离子不会成为任何反应的一部分,但当加入HCl时,H+是增加的,而平衡呢
CH3.COOH(aq)↔H+(aq)+ CH3.首席运营官-(aq)
被驱赶到左边。所有加入的H+(0.01 mol)与CH反应3.首席运营官-对CH3.羧基。
反应前后溶液1中酸类化合物的浓度为:
| [H+] | (CH3.首席运营官-] | (CH3.羧基) | |
| 在反应之前 | 0.010 mol/0.5 l = 0.020 M | 7.00米 | 7.00米 |
| 后的反应 | 0 | 6.98米 | 7.02米 |
然后,可以计算出反应后的pH值:
加入HCl后溶液1的pH值= 4.76 + log ([6.98]/[7.02]) = 4.76 - 0.0025 =4.76, pH无明显变化
反应前后溶液2中酸类化合物的浓度为:
| [H+] | (CH3.首席运营官-] | (CH3.羧基) | |
| 在反应之前 | 0.010 mol/0.5 l = 0.020 M | 0.070米 | 0.070米 |
| 后的反应 | 0 | 0.050米 | 0.090米 |
然后,可以计算出反应后的pH值:
加入HCl后溶液2的pH值= 4.76 + log ([0.050]/[0.090]) = 4.76 - 0.26 =4.50, pH值变化很小,但意义重大。
方案1的缓冲容量比方案2高得多。
图中显示了两种方案缓冲容量的差异:
例7:选择最佳缓冲溶液
你需要pH值为4.5的缓冲液,并有四种酸及其钠盐可用。你应该用哪种酸来得到最好的缓冲溶液?
你的酸:
- 氯乙酸
- 苯甲酸
- 丙酸
- 次氯酸
我们知道,当缓冲弱酸或弱碱进行pK时,缓冲效果最佳一个值接近所需pH值。
所以我们需要比较酸pK一个s的pH值为4.5。如果我们看一下pK一个无机酸的含量而且pk一个由酚,醇和羧酸组成我们找到了pK一个酸的S:
氯乙酸:2.87
苯甲酸:4.20
丙酸:4.87
次氯酸:7.54
苯甲酸和丙酸都可以使用,但是的pK一个苯甲酸(4.20)的pH值最接近4.5,因此苯甲酸和苯甲酸钠盐会给出最有效的缓冲溶液。
则酸平衡方程为:
C6H5羧基(aq)↔h+(aq)+ C6H5首席运营官-(aq)
K一个= [H+] [C6H5首席运营官-] / [C6H5COOH和[C]6H5首席运营官-] / [C6H5Cooh] = k一个/ (H+]
pH = 4.50对应的浓度为[H .+= 10(-4.50)= 3.16 * 105
pKa表示苯甲酸是4.20,所以是K一个= 10(-4.20)= 6.31 * 105
然后,[C6H5首席运营官-] / [C6H5Cooh] = 6.31*105/ 3.16 * 105= 2.0
这意味着钠盐的浓度必须是苯甲酸浓度的2倍。
如果你从1.0升1.0 M苯甲酸开始,你可以加入1.0升2.0 M苯甲酸钠。(M = mol/ l溶液)